酸化剤は一般に、細胞分裂、炎症、免疫機能、自食作用、およびストレス反応を含む、人体における必須の過程を調節するために制御された方法で産生される。 しかしながら、これらの酸化剤の制御されていない生成は、一因となり得る。 酸化的ストレス、細胞機能に影響を及ぼし、毒性や慢性疾患の発症につながる可能性があります。
目次
抽象
転写因子 NF-E2 p45 関連因子 2 (Nrf2、遺伝子名 NFE2L2) は、抗酸化酵素、抗炎症酵素、解毒酵素などの細胞保護タンパク質の多様なネットワークの遺伝子発現を調節することにより、ストレス条件下での適応と生存を可能にします。損傷した高分子の修復または除去を助けるタンパク質として。 Nrf2 は、グルタチオン、チオレドキシン、NADPH の生合成、利用、再生を調節し、ミトコンドリアと NADPH オキシダーゼによる活性酸素種の生成を制御することにより、細胞の酸化還元恒常性の維持に重要な役割を果たしています。 恒常性条件下では、Nrf2 はミトコンドリア膜電位、脂肪酸酸化、呼吸のための基質 (NADH および FADH2/コハク酸塩) の利用可能性、および ATP 合成に影響を与えます。 ストレスまたは成長因子刺激の条件下では、Nrf2 の活性化は、脱共役タンパク質 3 の転写上方制御を介してミトコンドリアにおける活性酸素種の産生の増加に対抗し、核呼吸因子 1 およびペルオキシソーム増殖因子活性化受容体のレベルを維持することによってミトコンドリアの生合成に影響を与えます。 コアクチベーター 1?、およびプリンヌクレオチド生合成を促進することによって。 天然に存在するイソチオシアネートスルフォラファンなどの薬理学的 Nrf2 活性化剤は、酸化剤を介したミトコンドリア透過性遷移孔の開口とミトコンドリアの膨張を阻害します。 興味深いことに、合成 1,4-ジフェニル-1,2,3-トリアゾール化合物は、元々は次のように設計されました。
キーワード: 生体エネルギー論、細胞保護、Keap1、ミトコンドリア、Nrf2、フリーラジカル
特徴
- Nrf2は、細胞の酸化還元恒常性を維持するのに重要な役割を果たしています。
- Nrf2はミトコンドリア膜電位とATP合成に影響を与えます。
- Nrf2はミトコンドリア脂肪酸酸化に影響を与えます。
- Nrf2はミトコンドリアの構造的および機能的完全性を支持する。
- ミトコンドリア機能が低下した場合、Nrf2活性化剤は有益な効果を発揮します。
概要
転写因子NF-E2p45関連因子2(Nrf2;遺伝子名NFE2L2)は、多様な細胞保護活性を持つタンパク質をコードする遺伝子のネットワークの発現を調節します。 Nrf2自体は、主にタンパク質の安定性のレベルで制御されます。 基礎条件下では、Nrf2は短命のタンパク質であり、継続的なユビキチン化とプロテアソーム分解を受けます。 Nrf2の分解に寄与する2つの既知のユビキチンリガーゼシステムがあります。 歴史的に、発見されたNrf1の最初の負の調節因子は、ケルチ様ECH関連タンパク質1(Keap1)[3]、カリン3(Cul1)/ Rbx2ユビキチンリガーゼの基質アダプタータンパク質でした[3]、[4]、[ 1]。 Keap2は、非常に効率的な周期的メカニズムを使用して、ユビキチン化とプロテアソーム分解のためにNrf1を標的とし、その間にKeap1は継続的に再生され、周期を進行させます(図5A)[2]。 Nrf3は、グリコーゲンシンターゼキナーゼ(GSK)1 /?-TrCP依存性のCul6ベースのユビキチンリガーゼによって媒介される分解にもさらされます[7]、[2]。 ごく最近、小胞体ストレスの状態の間に、Nrf3がユビキチン化され、E1ユビキチンリガーゼHrd8によって媒介されるプロセスで分解されることが報告されました[XNUMX]。
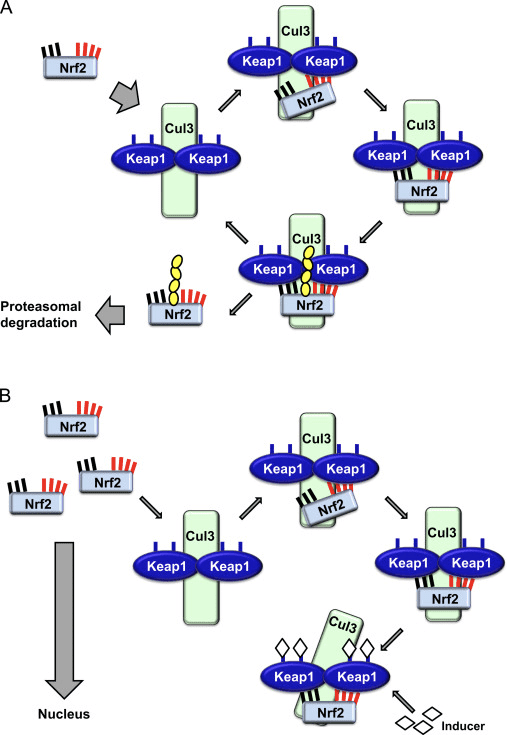
ユビキチンリガーゼ基質アダプタータンパク質としての役割を果たすことに加えて、Keap1は、Nrf2(インデューサーと呼ばれる)の広範な小分子活性化剤のセンサーでもあります[9]。 インデューサーは、Keap1 [2]、[1]内の特定のシステイン残基を化学的に修飾することによって、または直接Keap10:Nrf11結合インターフェース[1]、[2]を破壊することによって、Keap12を介したNrf13の分解サイクルを阻止する。 その結果、Nrf2は分解されず、転写因子は蓄積して核に転座し(図1B)、そこで小さなMafタンパク質とヘテロ二量体を形成する。 その標的遺伝子の上流の調節領域である抗酸化応答要素に結合する。 そして転写[14]、[15]、[16]を開始します。 一連のNrf2標的は、生体異物代謝の酵素を含む多様な細胞保護機能を有するタンパク質、抗酸化および抗炎症機能を有するタンパク質、およびプロテアソームサブユニット、ならびに細胞酸化還元恒常性を調節し中間代謝に関与するタンパク質を含む。
Nrf2: 細胞レドックス H のマスターレギュレーターオメオスタシス
細胞の酸化還元ホメオスタシスのマスターレギュレーターとしての Nrf2 の機能は広く認識されています。 β-の触媒サブユニットと調節サブユニットの両方の遺伝子発現
細胞酸化還元恒常性の主な調節因子としてのNrf2の決定的な役割を考えると、WT細胞と比較して、Nrf2が破壊された細胞において活性酸素種(ROS)のレベルが高いことは驚くことではない(Nrf2-KO)。 [35] この違いは、酸化ストレスを引き起こす薬剤による攻撃で特に顕著です。 さらに、Nrf2が欠損した細胞は、さまざまな種類の酸化剤の毒性に対してはるかに敏感であり、Nrf2誘導物質によって保護することはできません。これは、同じ条件下で、WT細胞に対して効率的で長期にわたる保護を提供します[29]、[36]。 、[37]。 全体的な細胞酸化還元恒常性に加えて、Nrf2もミトコンドリア酸化還元恒常性の維持に重要です。 したがって、WTと比較して、総ミトコンドリアNADHプールは、KeapXNUMX − KO細胞において有意に増加し、NrfXNUMX − KO細胞において劇的に減少する[XNUMX]。
生細胞イメージングを使用して、我々は最近、WT、Nrf2-KO、またはKeap1ノックダウン(Keap1-KD)マウスから分離された初代神経膠ニューロン共培養および脳組織切片におけるROS産生の速度をモニターした[38]。 予想通り、ROS産生速度は、それらのWT対応物と比較してNrf2-KO細胞および組織においてより速かった。 しかしながら、WTとKeap1-KD遺伝子型の間の差異の大きさはWTとNrf1-KOの間のそれよりも小さいが、WTと比較して、Keap2-KD細胞はより高いROS産生率を有するという予想外の観察を行った。 。 次に、脳の病理に関与している2つのNADPHオキシダーゼ(NOX)アイソフォームの触媒サブユニットであるNOX2とNOX4のmRNAレベルを分析し、Nrf2欠損の条件下でNOX2が劇的に増加するのに対して、Nrf4は上方調節されるより少ない程度ではあるが、構成的に活性化されている。 定量的には、変異マウスからの細胞および組織における上方制御の規模は、対応するROS産生の増加と平行している[2]。 興味深いことに、Nrf38はNADPHオキシダーゼを調節するだけでなく、肺上皮細胞および心筋細胞で示されるように、NADPHオキシダーゼによって産生されるROSはNrf2を活性化することができる[2]、[39]。 さらに、ごく最近の研究は、Nrf40のNADPHオキシダーゼ依存性活性化が、慢性的な圧負荷の間の心臓のミトコンドリア損傷および細胞死に対する保護のための重要な内因性メカニズムを構成することを証明した[2]。
NADPHオキシダーゼの触媒活性に加えて、ミトコンドリア呼吸はROSの別の主要な細胞内起源である。ミトコンドリア特異的プローブMitoSOXの使用により、単離された初代神経膠ニューロン共培養における全体のROS生産に対するミトコンドリア起源のROSの寄与を調べた。 WT、Nrf2-KO、またはKeap1-KDマウス[38]から。 予想通り、Nrf2-KO細胞はWTよりもミトコンドリアROS産生率が高かった。 全体的なROS産生についての知見と一致して、KeapXNUMX − KDにおけるミトコンドリアROS産生の割合もまた、WT細胞と比較してより高かった。 重要なことに、ロテノンで複合体Iを遮断することは、WT細胞およびKeapXNUMX − KD細胞の両方においてミトコンドリアROS産生の劇的な増加を引き起こしたが、NrfXNUMX − KO細胞においては効果がなかった。 ピルビン酸添加後のWT細胞におけるミトコンドリアROS産生の予想される増加とは対照的に(NADHの利用可能性を高め、ミトコンドリア膜電位を高め、呼吸を正常化するために)、Nrf1-KO細胞においてROSの産生は減少した。 まとめると、これらの知見は、Nrf1の非存在下では、(i)複合体Iの活性が損なわれている、(ii)複合体Iの活性が損なわれていること、および(iii)複合体の活性が損なわれていることを強く示唆する。ミトコンドリアのROS産生が増加した主な理由の1つは、おそらく複合体IIからの電子の逆流によるものです。
Nrf2はミトコンドリア膜電位と呼吸に影響する
ミトコンドリア膜電位(?? m)は、ミトコンドリアの健康と細胞の代謝状態の普遍的な指標です。 健康な細胞では、?? mはミトコンドリア呼吸鎖によって維持されます。 興味深いことに、エストロゲン受容体陰性の非腫瘍形成性ヒト乳房上皮MCF10A細胞株における培養ベースのプロテオミクス研究におけるアミノ酸による安定した同位体標識は、ミトコンドリアの電子伝達系成分NDUFA4がNrf2の薬理学的活性化(スルホラファンによる)によってアップレギュレートされることを示しました。一方、Nrf2の遺伝的アップレギュレーション(Keap1ノックダウンによる)は、チトクロームcオキシダーゼサブユニットCOX2およびCOX4I1のダウンレギュレーションにつながります[42]。 二次元ゲル電気泳動とマトリックス支援レーザー脱離/イオン化質量分析を使用した肝臓プロテオームの研究は、Nrf2がATPシンターゼサブユニットの発現を調節することを発見しましたか? [43]。 さらに、複合体Iの活性の維持に役割を果たすミトコンドリアタンパク質DJ-1 [44]は、薬理学的または遺伝的活性化の神経保護効果はあるものの、Nrf2 [45]、[46]を安定化させることが報告されています。 Nrf2のはDJ-1から独立しています[47]。 ただし、ミトコンドリア機能に対するこれらの観察結果の結果は調査されていません。
Nrf2欠損症の条件下での複合体Iの活性障害と一致して、基底?? mは、WT対応物と比較してNrf2-KOマウス胚性線維芽細胞(MEF)および培養初代神経膠神経細胞で低い(図3、挿入図)。 [35]。 対照的に、Nrf2が遺伝的に構成的にアップレギュレートされている場合(Keap1のノックダウンまたはノックアウトによって)、基底?? mは高くなります。 遺伝子型間の?? mのこれらの違いは、呼吸がNrf2の活動によって影響を受けることを示しています。 実際、基礎状態での酸素消費量の評価は、WTと比較して、酸素消費量がNrf2-KOおよびKeap1-KO MEFでそれぞれ約50%および約35%低いことを明らかにしました。
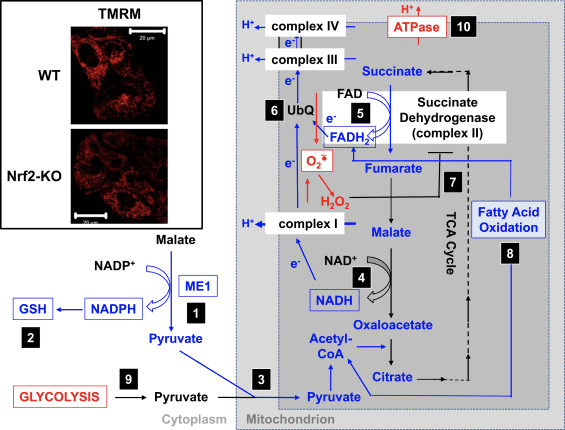
遺伝子型間の?? mと呼吸のこれらの違いは、ミトコンドリア呼吸のための基質の利用率に反映されています。 トリカルボン酸(TCA)回路の基質(リンゴ酸/ピルビン酸、これにより複合体I基質NADHの生成が増加)または複合体IIの基質であるコハク酸メチルの適用により、両方のWTで?? mが段階的に増加します。およびKeap1-KDニューロンですが、増加率はKeap1-KD細胞の方が高くなっています。 さらに重要なことに、これらのTCA回路基質に対する応答の形状は、1つの遺伝子型間で異なります。これにより、基質添加時のKeap50-KD細胞のμmの急激な上昇に続いて、プラトーではなく急速な低下が起こり、異常なことが示唆されます。速い基質消費。 これらの発見は、WT MEFと比較してKeap70-KOで[U-1C13]グルコースの6時間パルス後に観察されたリンゴ酸、ピルビン酸、およびコハク酸のはるかに低い(1〜24%)レベルと密接に一致しています。細胞[2]。 Nrf2-KOニューロンでは、ピルビン酸のみが?? mを増加させることができますが、リンゴ酸とコハク酸メチルは軽度の脱分極を引き起こします。 ミトコンドリア基質産生に対するNrf2の効果は、Nrf2がミトコンドリア機能に影響を与える主なメカニズムのようです。 ミトコンドリアNADHレドックスインデックス(複合体IによるNADHの消費とTCA回路でのNADPHの生成のバランス)は、WTの対応物と比較してNrf2-KO細胞で有意に低く、さらに、複合体IVの阻害後のNADHおよびFADHXNUMX(NaCNの使用による)は、変異細胞では遅くなります。
マウスの脳と肝臓から分離されたミトコンドリアでは、複合体Iまたは複合体IIの基質を補給すると、Nrf2が活性化されると酸素消費率がより強く増加し、Nrf2が破壊されると効率が低下します[35]。 したがって、リンゴ酸塩は、WTと比較してKeap1-KDでより高い酸素消費率を誘発しますが、その効果はNrf2-KOミトコンドリアでは弱いです。 同様に、ロテノンの存在下(複合体Iが阻害される場合)では、コハク酸はWTと比較してKeap1-KDでより大きな程度に酸素消費を活性化しますが、Nrf2-KOミトコンドリアでの応答は減少します。 さらに、Nrf2-KO初代神経細胞培養およびマウスは、複合体II阻害剤である3-ニトロプロピオン酸およびマロン酸の毒性に対してより感受性が高いのに対し、Nrf2過剰発現星状細胞の線条体内移植は保護的です[48]、[49]。 同様に、Nrf2-KOマウスは、Nrf2の遺伝的または薬理学的活性化が、1-メチル-4-フェニル-1の複合体I阻害剤4-メチル-1,2,3,6-フェニルピリジニウムイオンによって引き起こされる神経毒性に対する保護効果を持っているのに対し、より敏感です。パーキンソン病の49-テトラヒドロピリジン動物モデル[50]、[51]、[52]、[53]、[54]、[55]、[56]、[57]、[58]、 [59]、[60]、[61]、[XNUMX]。
Nrf3がない場合、状態4(ADP刺激)と状態2の呼吸(ADPが存在しない)の比率である呼吸制御比(RCR)は減少しますが、RCRはKeap1-KDとWTミトコンドリアの間で類似しています[35 ]。 RCRはミトコンドリア呼吸鎖活性の酸化的リン酸化への結合の程度の指標であるため、この発見は、Keap1-KDミトコンドリアの呼吸速度が高いのは酸化的リン酸化の脱結合によるものではないことを示しています。 さらに、Nrf2が活性化されると酸化的リン酸化がより効率的になることを示唆しています。 Keap1-KDミトコンドリアの呼吸数が高いことは、ミトコンドリアのROS生成レベルが高いことと一致しています[38]。呼吸数が高いと電子漏れが増加する可能性があるためです。 しかし、酸化ストレスの条件下では、ROS産生の増加は、ミトコンドリア内膜のプロトンコンダクタンスを増加させ、その結果、スーパーオキシドの産生を減少させる脱共役タンパク質2(UCP3)のNrf3依存性転写アップレギュレーションによって打ち消されます[62]。 ごく最近、脂質過酸化生成物である4-ヒドロキシ-2-ノネナールが心筋細胞におけるUCP2のNrf3依存性のアップレギュレーションを媒介することが示されました。 これは、虚血再灌流時などの酸化ストレスの条件下での保護に特に重要である可能性があります[63]。
Nrf2 は酸化的リン酸化と S の効率に影響を与える合成 ATPの
脳と肝臓のミトコンドリアにおける呼吸に対するNrf2の効果と一致して、Nrf2の欠乏は、酸化的リン酸化の効率の低下をもたらします(ATP合成に消費される酸素に対するADPの比率によって推定される)が、Nrf2の活性化(Keap1 -KD)は逆の効果があります[35]。 WTと比較して、ATPレベルはNrf2の構成的アップレギュレーションを伴う細胞で有意に高く、Nrf2がノックダウンされた場合[64]または破壊された場合[35]に低くなります。 さらに、酸化的リン酸化(オリゴマイシン)または解糖(ヨード酢酸)の阻害剤の使用は、Nrf2が細胞がATPを生成する方法を変えることを明らかにしました。 したがって、WTニューロンでは、オリゴマイシンはATPの完全な低下を引き起こし、ヨード酢酸はそれ以上の影響を及ぼしません。 注目すべきことに、Nrf2-KO細胞では、オリゴマイシンがATPレベルを増加させ、その後ゆっくりと、しかし完全にヨード酢酸によって枯渇させます。これは、Nrf2がない場合、酸化的リン酸化ではなく解糖がATP生成の主な原因であることを示しています。 興味深いことに、Keap1-KD細胞の酸化的リン酸化の効率が向上しているにもかかわらず、オリゴマイシンを添加するとATPレベルが約80%減少し、ヨード酢酸によってさらに約20%減少します。 したがって、Nrf2欠損症またはその構成的活性化のいずれかが、酸化的リン酸化の寄与を減少させ、ATPの合成に対する解糖の寄与を増加させます。 この効果は、Nrf2が存在しない場合に特に顕著であり、培地中のグルコースの存在[35]および解糖系中間体(G-6-P、F-6-P)のレベルの増加に対する?? mの依存性と一致しています。 、ジヒドロキシアセトンリン酸、ピルビン酸、および乳酸)Nrf2のノックダウン後[24]。
オリゴマイシンによるF1F0-ATPaseの阻害後のATPレベルの増加は、Nrf2の非存在下では、F1F0-ATPaseがATP合成酵素ではなく、ATPaseとして機能することを示しています。つまり、逆に動作します。 このような活動の逆転は、おそらく、このオルガネラの機能的完全性にとって重要である?? mを維持しようとして、ミトコンドリア内膜を横切ってプロトンをポンプで送る必要性を反映している。 F1F0-ATPaseの機能の逆転は、Nrf2-KO細胞へのオリゴマイシン投与時に観察されたミトコンドリア脱分極によっても証明されます。これは、WTまたはKeap1欠損の対応物で発生する過分極とは対照的です[35]。 全体として、Nrf2欠損の条件下では、ATPは主に解糖系で生成され、このATPはF1F0-ATPaseによって部分的に使用されて?? mを維持しているようです。
Nrf2はミトコンドリア脂肪酸Oを強化します酸化
細胞がグルコースを含まない培地でインキュベートされた場合、?? mに対するNrf2欠損の影響は特に顕著であり、?? mはWT細胞と比較してNrf50-KOで約2%低い[35]。 グルコース欠乏の条件下では、ミトコンドリアの脂肪酸酸化(FAO)は、呼吸と酸化的リン酸化の基質の主要なプロバイダーであり、Nrf2がFAOに影響を与える可能性があることを示唆しています。 実際、長鎖(C16:0)飽和脂肪酸パルミチン酸と短鎖(C6:0)ヘキサン酸の両方に対するFAOの効率は、Keap1-KOMEFと単離された心臓および肝臓ミトコンドリアの方が高くなっています。 WTの対応物、Nrf2-KO細胞とミトコンドリアでは低い[65]。 これらの影響は人間にも非常に関連しています。実際、FAOとTCA回路の活動とのより良い統合を示す代謝変化は、古典的なNrf2活性化因子スルフォラファンの前駆体であるグルコラファニンが豊富な食事による人間の介入研究で発生することが報告されています[ 66]。
ミトコンドリアFAOの最初のステップで、β-炭素のプロR水素が水素化物として残り、FAD補因子をFADH2に還元します。これにより、電子が呼吸鎖のユビキノン(UbQ)に移動し、最終的にATP生成に寄与します。 。 グルコースの非存在下でのパルミトイルカルニチンによるFAOの刺激は、WTおよびKeap1-KO細胞のATPレベルの予想される増加を引き起こし、Keap1-KO細胞ではATPの上昇が速くなりますが、同じ処理ではNrf2-KOのATP変化は生じません。 MEF [65]。 この実験は、Nrf2の非存在下では、FAOが抑制されることを示しており、さらに、Nrf2欠乏の条件下でATPレベルが低下する理由の35つとしてFAOの抑制を示唆しています[64]、[XNUMX]。
特に、Nrf293が沈黙しているヒト2 T細胞は、CPT1とCPT2 [67]、カルニチンパルミトイルトランスフェラーゼ(CPT)、ミトコンドリアFAOの律速酵素の2つのアイソフォームの低い発現があります。 一致して、CptXNUMXのmRNAレベルは、WTマウスと比較してNrfXNUMX − KOの肝臓において低い[XNUMX]。 CPTは、長鎖脂肪アシル−CoAのアシル基の補酵素Aから1−カルニチンへの転移を触媒し、そしてそれ故アシルカルニチンの細胞質からミトコンドリアへの移入を可能にする。 これは今日まで調べられていないが、CPT1発現に対する転写効果に加えて、Nrf2はその主要アロステリック阻害剤、マロニル-CoAのレベルを制御することによってこの酵素の機能にも影響を及ぼし得る可能性がある。 これは、現在不明なメカニズムにより、Nrf68がステアロイルCoAデサチュラーゼ(SCD)[1]およびクエン酸リアーゼ(CL)[2]、[2]の発現を負に調節するためである。 奇妙なことに、SCDのノックアウトまたは阻害はAMP活性化プロテインキナーゼ(AMPK)[69]、[69]のリン酸化および活性化の増加をもたらし、そしてNrf70の非存在下では、SCDレベルは推測できる。 AMPK活性が低下します。 これは、Nrf71-KOマウスの肝臓で観察されているAMPKのタンパク質レベルの低下[72]によってさらに悪化する可能性があり、これは、Keap73-KDの肝臓で報告されているAMPKレベルの上昇とよく一致する。マウス[2] AMPK活性の低下の1つの結果は、アセチル-CoAカルボキシラーゼ(ACC)[2]のその抑制的リン酸化の軽減であり、これはNrf68活性化により下方制御されるため、Nrf1がさらに転写的に上方制御され得る[74]。 ]。 ACCの基質であるアセチルCoAの産生を増加させるであろう上方制御されたCL発現と組み合わせた高いACC活性は、最終的にはACC産物、マロニルCoAのレベルを増加させる可能性がある。 高レベルのマロニル-CoAはCPTを阻害し、それによってミトコンドリアへの脂肪酸の輸送が減少する。 最後に、Nrf79は、CD75 [2]、形質膜とミトコンドリア膜を横切って脂肪酸を輸入するトランスロカーゼの発現を積極的に調節します。 したがって、Nrf2がミトコンドリアFAOの効率に影響を及ぼし得る1つのメカニズムは、ミトコンドリアへの長鎖脂肪酸の輸入を調節することによるものである。
直接転写調節に加えて、Nrf2はまた、細胞の酸化還元代謝に対するその効果によってミトコンドリアFAOの効率を変える可能性があります。 これは、Nrf2活性が低いかまたは存在しない場合、細胞の酸化還元状態を酸化状態にシフトさせる条件に特に関連し得る。 実際、いくつかのFAO酵素が酸化還元変化に敏感であると同定されています。 そのような酵素の1つは、超長鎖アシルCoAデヒドロゲナーゼ(VLCAD)であり、これは、ヒト組織におけるパルミトイルCoA脱水素活性に80%を超える割合で寄与する[77]。 興味深いことに、Hurdら。 [78]は、VLCADが、単離されたラット心臓ミトコンドリアをH2O2に曝露するとそれらの酸化還元状態を有意に変化させるシステイン残基を含むことを示した。 さらに、Cys238でのマウス肝臓VLCADのS-ニトロシル化は、酵素[79]の触媒効率を改善し、そして同じシステインの酸化が反対の効果を持ち、最終的にミトコンドリアFAOの効率を低下させる可能性がある。 したがって、VLCADの発現レベルはWT、Nrf2-KO、またはKeap1-KO MEF [65]では有意に異ならないが、VLCADの酵素活性はNrf2の非存在下ではより高いレベルのために低くなる可能性がある。 ROSの。
これらすべての発見に基づいて、(図3):Nrf2がない場合、ME1、IDH1、G6PD、およびPGDの発現が減少するため、NADPHレベルが低くなることが提案されます。 還元型グルタチオンのレベルは、その生合成と再生に関与する酵素の発現が減少し、酸化型グルタチオンから還元型グルタチオンへの変換に必要なNADPHのレベルが低いためにも低くなります。 ME1の発現が低いと、ミトコンドリアに入るピルビン酸のプールが減少し、解糖系がピルビン酸の主要な供給源になります。 NADHの生成は遅く、複合体Iの活性が損なわれ、ミトコンドリアのROS産生が増加します。 FADからFADH2への還元も遅くなりますが、これは少なくとも部分的には脂肪酸の酸化効率が低く、FADH2からUbQおよび複合体IIIへの電子の流れが損なわれるためです。 UbQH2はコハク酸デヒドロゲナーゼの活性化因子であるため[80]、その形成を遅くするとコハク酸デヒドロゲナーゼの酵素活性が低下する可能性があります。 スーパーオキシドと過酸化水素のレベルの上昇は、複合体IIの活性をさらに阻害する可能性があります[81]。 脂肪酸酸化の効率が低いと、酸化的リン酸化におけるミトコンドリア呼吸とATP生成のための基質の利用可能性が低下します。 代償メカニズムとして、解糖が強化されます。 ATP合成酵素は、?? mを維持しようとして、ATPaseとして逆に機能します。
Nrf2 とミトコンドリア Bイオジェネシス
WTと比較して、Nrf2-KOマウスの肝臓はミトコンドリア含有量が低いことが報告されています(ミトコンドリアと核DNAの比率によって決定されます)。 これは、WTマウスとNrf24-KOマウスの両方で2時間の速さでさらに減少します。 対照的に、通常の摂食条件下でのWTと違いはありませんが、Nrf2活性の高いマウスのミトコンドリア含有量は絶食の影響を受けません[82]。 興味深いことに、Nrf2活性化因子(R)-α-リポ酸の補給[83]、[84]、[85]は、3T3-L1脂肪細胞のミトコンドリア生合成を促進します[86]。 核転写調節因子の11つのクラスは、ミトコンドリアの生合成において重要な役割を果たします。 最初のクラスは、核呼吸因子2および88などの転写因子であり、89つの呼吸複合体のサブユニット、ミトコンドリア翻訳成分、およびミトコンドリアマトリックスに局在するヘム生合成酵素をコードする遺伝子の発現を制御します[2]。 Piantadosi etal。 [1]は、核呼吸因子82のNrf2依存性転写アップレギュレーションがミトコンドリア生合成を促進し、心毒性アントラサイクリン化学療法剤ドキソルビシンの細胞毒性から保護することを示しています。 対照的に、張等。 [1]は、NrfXNUMXの遺伝的活性化がマウス肝臓における核呼吸因子XNUMXの基本的なmRNA発現に影響を与えないことを報告しています。
ミトコンドリア生合成において重要な機能を持つ核転写調節因子の1番目のクラスは、ペルオキシソーム増殖因子活性化受容体などの転写コアクチベーターですか? コアクチベーター(PGC)1? および88?は、転写因子、基本的な転写およびRNAスプライシング機構、およびヒストン修飾酵素と相互作用します[90]、[91]、[1]。 コアクチベーターのPGC2ファミリーの発現は、多数の環境シグナルの影響を受けます。 Nrf1活性化因子スルフォラファンによるヒト線維芽細胞の治療はミトコンドリア量の増加とPGC1の誘導を引き起こしますか? とPGC92? [2]、ただし、この研究ではNrf2への潜在的な依存性は調べられていません。 ただし、Nrf1がKeap1遺伝子の低形態ノックダウン(db / db:Keap2flox /?:Nrf1 + / +)によって活性化されるか、破壊される(db / db:Keap2flox /?:Nrf1?/?)糖尿病マウスは、肝臓のPGC1が低くなりますか? 対照動物よりも発現レベル(db / db:Keap2flox / +:Nrf93 + / +)[1]。 PGC2のmRNAレベルに違いはありませんか? WTまたはNrf2-KOのいずれかである非糖尿病マウスの肝臓で見られますが、これらのレベルはNrf1過剰発現(Keap1-KDおよび肝臓特異的Keap82-KO)動物では低くなります[24]。 特に、1時間の高速はPGC2のレベルを増加させますか? すべての遺伝子型のマウスの肝臓におけるmRNAですが、WTまたはNrf2を過剰発現するマウスと比較して、Nrf2-KOの肝臓では増加が有意に大きくなっています。 WTと比較して、敗血症性感染または感染による急性肺損傷を経験しているNrf1-KOマウスは、核呼吸因子1およびPGC94の転写アップレギュレーションの減弱を示していますか? [95]、[2]。 一緒に、これらの観察は、核呼吸因子1とPGC1の両方のレベルを維持することにおけるNrfXNUMXの役割を示唆していますか? 複雑で、ストレスのある条件下で最も顕著になります。
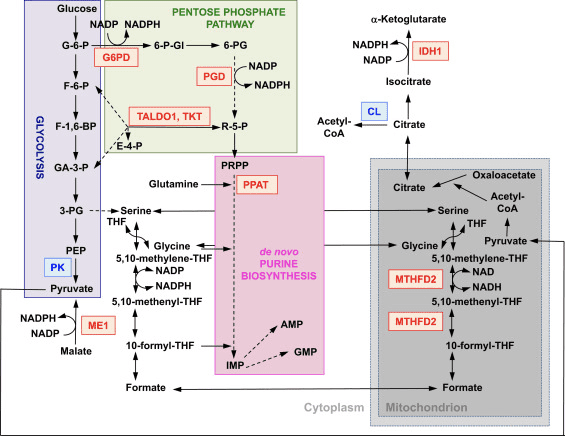
ミトコンドリアタンパク質をコードする遺伝子の発現に加えて、ミトコンドリアの生合成にはヌクレオチドの合成が必要です。 Nrf2の遺伝的活性化は、特に急速に増殖する細胞において、ペントースリン酸経路と葉酸およびグルタミンの代謝をアップレギュレートすることにより、プリン生合成を促進します(図2)[24]。 ミトコンドリアセリン/スレオニンプロテインキナーゼPTEN誘導推定キナーゼ1(PINK1)を欠損した変異ドロソフィラのトランスクリプトームの分析は、ミトコンドリア機能障害がヌクレオチド代謝に影響を与える遺伝子の転写アップレギュレーションにつながることを示しており[96]、ヌクレオチド生合成の増強を示唆しているPINK1欠損症の神経毒性の結果に対する保護のメカニズムを表します。 Nrf2は、denovoプリンヌクレオチド生合成経路への侵入を触媒するホスホリボシルピロリン酸アミドトランスフェラーゼ(PPAT)、およびミトコンドリアのメチレンテトラヒドロ葉酸デヒドロゲナーゼ2(MTHFD2)の発現を調節します(図2)。 後者は、急速に成長する細胞におけるプリン生合成のための97炭素単位の供給源としてグリシンとギ酸塩の両方を提供するのに重要なデヒドロゲナーゼおよびシクロヒドロラーゼ活性を有する二機能性酵素です[2]。 したがって、Nrf1の活性化は保護的であり、PINK2欠損症のミトコンドリア機能障害を逆転させる可能性があります。 確かに、スルフォラファンまたはトリテルペノイドRTA-408によるNrf1の薬理学的活性化は、?? mを回復し、ドーパミン毒性からPINK98欠損細胞を保護します[2]。 根底にあるメカニズムは複雑に見えますが、これらの発見は、NrfXNUMX活性が、重要な転写因子とコアクチベーターの発現レベルに影響を与えることによって、またヌクレオチド生合成を強化することによって、ミトコンドリアの生合成に影響を与える可能性があることを示しています。
Nrf2 とミトコンドリア Iインテグリティ
直接的な証拠は必ずしも入手可能ではないが、Nrf2がミトコンドリアの完全性にとって、特に酸化ストレスの条件下で重要であるという強い示唆がある。 Nrf2活性化剤スルフォラファンの単回投与を受けたラットの脳および肝臓から単離されたミトコンドリアは、酸化剤tert-ブチルヒドロペルオキシド[99]、[100]によって引き起こされるミトコンドリア透過性遷移細孔(mPTP)の開口に対して耐性がある。 ミトコンドリア内膜が1500 Daまでの質量を有する分子に対して透過性になることを可能にする複合体であるmPTPは最近F0F1-ATPシンターゼ[101]の二量体から形成されることが確認された。 mPTP開口に対するスルフォラファン媒介耐性は抗酸化防御の増加と相関し、ミトコンドリアGSH、グルタチオンペルオキシダーゼ1、リンゴ酸酵素3、およびチオレドキシン2のレベルはすべてスルフォラファン治療動物から単離されたミトコンドリア画分においてアップレギュレートされる[100]。
求電子性脂質過酸化生成物4-ヒドロキシ-2-ノネナールによって引き起こされるミトコンドリアタンパク質の損傷と呼吸障害は、スルフォラファン処理マウスの大脳皮質から分離されたミトコンドリアで弱められます[102]。 ラット腎上皮細胞および腎臓では、スルフォラファンはシスプラチンおよびゲンタマイシンによって誘発される毒性および?? mの喪失に対して保護的です[103]、[104]。 酸化剤(スーパーオキシド、過酸化水素、ペルオキシナイトライト)および求電子試薬(4-ヒドロキシ-2-ノネナールおよびアクロレイン)のパネルに対する保護、およびミトコンドリアの抗酸化防御の増加も、ラット大動脈平滑筋細胞をスルフォラファンで処理すると観察されています[105 ]。 造影剤誘発性急性腎障害のモデルにおいて、四肢の虚血性プレコンディショニングは、GSK2の阻害の結果としてのNrf3の活性化によって、mPTPの開口およびミトコンドリアの腫れの阻害を含む保護効果を有することが最近示された? [106]。
マイトファジーは、機能不全のミトコンドリアがオートファゴソームに選択的に飲み込まれ、リソソームに送達されて細胞によって分解および再利用されるプロセスであり、ミトコンドリアの恒常性に不可欠です[107]、[108]。 Nrf2とマイトファジーの因果関係は確立されていませんが、転写因子がマイトファジーで役割を果たすことにより、ミトコンドリアの品質管理に重要である可能性があるという証拠があります。 これは、酸化ストレスの条件下で特に顕著になる可能性があります。 したがって、敗血症のモデルでは、感染後1時間でのオートファゴソームマーカーMAP3軽鎖3-II(LC62-II)およびカーゴタンパク質p24のレベルの増加は、WTマウスと比較してNrf2-KOで抑制されます[109]。 。 マイトファジーの小分子インデューサー(p62を介したマイトファジーインデューサー、PMIと呼ばれる)が最近発見されました。 この1,4-ジフェニル-1,2,3-トリアゾール化合物は、もともと転写因子とKeap2の相互作用を妨害するNrf1活性化因子として設計されました[110]。 Nrf2が遺伝的にアップレギュレートされている細胞(Keap1-KDまたはKeap1-KO)と同様に、PMIに曝露された細胞はより高い休止?? mを持っています。 重要なことに、WT細胞のPMI処理後に観察されるミトコンドリアLC3局在化の増加は、Nrf2-KO細胞では発生せず、Nrf2の関与を示唆しています。
最後に、肝臓切片の超微細構造分析は、2週の間高脂肪食を与えられていたNrf24-KOの肝細胞ではクリステが減少し膜が破壊された膨潤ミトコンドリアの存在を明らかにした。 特に、これらの肝臓は酸化ストレスと炎症の明白な証拠を示しています[68]。 Nrf2は、酸化ストレスおよび炎症ストレスの条件下でミトコンドリアの完全性を維持するのに重要な役割を果たしていると結論付けることができます。
スルフォラファンとその癌、死亡率、老化、脳と行動、心臓病などへの影響
イソチオシアネートは、食事から摂取できる最も重要な植物化合物の一部です。 この中で
主要なセクション:
- 00:01:14 - がんと死亡
- 00:19:04 - エージング
- 00:26:30 - 脳と行動
- 00:38:06 - 最後の要約
- 00:40:27 - 線量
フルタイムライン:
- 00:00:34 - ビデオの主な焦点であるスルフォラファンの紹介。
- 00:01:14 - 十字架植物の消費と全死亡率の低下。
- 00:02:12 - 前立腺がんのリスク。
- 00:02:23 - 膀胱がんのリスク。
- 00:02:34 - 喫煙者のリスクのある肺癌。
- 00:02 - 乳がんリスク。
- 00:03:13 - 仮説:既にがんになったら? (介入)
- 00:03:35 – もっともらしいメカニズムの駆動
癌 死亡率連想データ。 - 00:04:38 - スルフォラファンとがん。
- 00:05:32 –動物の証拠を示す
強い ラットの膀胱腫瘍の発生に対するブロッコリースプラウト抽出物の効果。 - 00:06:06 - 前立腺癌患者におけるスルフォラファンの直接補充の効果。
- 00:07:09 - 実際の乳房組織におけるイソチオシアネート代謝産物の生物濃縮。
- 00:08:乳癌幹細胞の抑制。
- 00:08:53 - ヒストリーレッスン:ブラシカは古代ローマでさえ健康的な特性を持つものとして確立されました。
- 00:09:16 - Sulforaphaneの発癌性排泄を高める能力(ベンゼン、アクロレイン)。
- 00:09:51 - NRF2は抗酸化物質を介して遺伝子スイッチとして働きます。
- 00:10:10 - NRF2活性化がグルタチオン-S結合体を介して発癌物質の排出をどのように高めるか
- 00:10:34 - Brussels sproutsはグルタチオン-S-トランスフェラーゼを増加させ、DNA損傷を減らします。
- 00:11:20 - ブロッコリー発芽飲料はベンゼン排泄を61%増加させる。
- 00:13:31 - ブロッコリースプラウトホモジネートは、上気道の抗酸化酵素を増加させます。
- 00:15:45 - 十字架植物の消費と心臓病の死亡。
- 00:16:55 - ブロッコリー発芽粉は、2型糖尿病患者の血中脂質および心臓病のリスクを改善します。
- 00:19:04 –の始まり
高齢化 のセクションから無料でダウンロードできます。 - 00:19:21 – スルフォラファンを豊富に含む食事は、
寿命 15から30%へのカブトムシ類(特定の条件において)。 - 00:20:34 - 長寿のための低炎症の重要性。
- 00:22:05 - 十字架野菜やブロッコリーの発芽粉は、人間の広範な炎症マーカーを減少させるようです。
- 00:23:40 - 中途半端なビデオ要約:がん、エイジングセクション
- 00:24:14 - マウス研究は、スルホラファンが老年期の適応免疫機能を改善する可能性があることを示唆している。
- 00:25:18 – スルフォラファンは、ハゲのマウスモデルの発毛を改善しました。
画像 00:26:10。 - 00:26:30 - 脳と行動セクションの始まり。
- 00:27:18 - ブロッコリースプラウト抽出物が自閉症に及ぼす影響。
- 00:27:48 - 統合失調症に対するグルコラファファインの効果。
- 00:28:17 - うつ病訴訟の開始(その可能性のあるメカニズムと研究)。
- 00:31:21 – ストレス誘発性うつ病の10の異なるモデルを使用したマウス研究では、スルフォラファンがフルオキセチンと同様に効果的であることが示されています(
プロザック ). - 00:32:00 - マウスにおけるグルコラファファインの直接摂取が、社会的敗北ストレスモデルからのうつ病の予防において同様に効果的であることを示す研究。
- 00:33:01 - 神経変性セクションの始まり。
- 00:33:30 - スルフォラファンおよびアルツハイマー病。
- 00:33:44 - スルフォラファンとパーキンソン病。
- 00:33:51 - スルフォラファンとハンチントン病。
- 00:34:13 - Sulforaphaneは熱ショックタンパク質を増加させます。
- 00:34:43 - 外傷性脳傷害のセクションの始まり。
- 00:35:01 - TBIの直後に注射されたスルフォラファンは記憶を改善する(マウス研究)。
- 00:35:55 - Sulforaphaneとニューロンの可塑性。
- 00:36:32 –スルフォラファンは
- 00:37:19 –スルフォラファンと
デュシェンヌ 筋ジストロフィー。 - 00:37:44 - 筋肉衛星細胞のミオスタチン阻害(インビトロ)。
- 00:38:06 - 死亡率と癌、DNA損傷、酸化ストレスと炎症、ベンゼン排泄、心血管疾患、II型糖尿病、脳への影響(うつ病、自閉症、統合失調症、神経変性)、NRF2経路。
- 00:40:27 - ブロッコリーの芽またはスルフォラファンの量を計算することについての考え方。
- 00:41:01 - 自宅での発芽に関する逸話。
- 00:43:14 - 調理温度とスルフォラファンの活性について。
- 00:43:45 - グルコラファファインからのスルフォラファンの腸内細菌転換。
- 00:44:24 - サプリメントは野菜からの活性ミロシナーゼと併用するとより効果的です。
- 00:44:56 - 料理技術と十字架野菜。
- 00:46:06 - 甲状腺ホルモンとしてのイソチオシアネート。

Nrf2は、人体の細胞抗酸化防御システムにおいて重要な役割を果たす転写因子です。 抗酸化応答要素、またはAREは、遺伝子の調節メカニズムです。 多くの研究研究は、Nrf2、またはNF-E2関連因子2が、いくつかの種類の細胞にわたって広範囲のARE駆動遺伝子を調節することを実証している。 NrfXNUMXはまた、細胞保護および抗発癌性において本質的な役割を果たすことが見出された。これは、NrfXNUMXが、酸化ストレスによって引き起こされると考えられる神経変性疾患および癌の管理において有効な治療法であり得ることを実証する。
Dr. Alex Jimenez DC、CCST Insight
結論 Rエマークス
多くの疑問が未解決のままであるが、利用可能な実験的証拠は明らかにNrf2がミトコンドリア恒常性および構造的完全性の維持において重要な役割を果たしていることを示している。 この役割は、Nrf2を介した細胞保護応答を上方制御する能力が細胞および生物の全体的な健康状態および生存に影響を及ぼす場合、酸化的、求電子的、および炎症性ストレスの条件下で特に重要になる。 ミトコンドリア機能におけるNrf2の役割は、この転写因子によって組織化された広範な細胞保護メカニズムの別の層を表しています。 多くのヒトの病理学的状態はそれらの病因の必須成分として酸化ストレス、炎症およびミトコンドリア機能不全を有するので、Nrf2の薬理学的活性化は疾患の予防および治療に有望である。 Nrf2がミトコンドリア機能に影響を与える正確なメカニズムの包括的な理解は、将来の臨床試験の合理的設計に不可欠であり、治療効果を監視するための新しいバイオマーカーを提供するかもしれません。
謝辞
Sciencedirect.com/science/article/pii/S0891584915002129
上記の記事の目的は、ミトコンドリア機能におけるNrf2の新たな役割について議論し、実証することでした。 Nrf2、または 核因子赤血球2関連因子は、酸化ストレスに寄与し、細胞機能に影響を及ぼし、毒性、慢性疾患、さらには癌の発症につながる可能性のある酸化剤に対する細胞耐性の新たな調節因子です。 人体での酸化剤の生成は、細胞分裂、炎症、免疫機能、オートファジー、ストレス反応などのさまざまな目的に役立ちますが、健康上の問題を防ぐために過剰生成を制御することが不可欠です。 私たちの情報の範囲は、カイロプラクティックと脊椎の健康問題に限定されています。 主題について話し合うには、ジメネス博士に気軽に尋ねるか、次のアドレスまでお問い合わせください。 915-850-0900 .
アレックス・ヒメネス博士によるキュレーション
参照元: Sciencedirect.com

追加のトピックディスカッション:急性腰痛
背中の痛み 障害の最も一般的な原因の1つであり、世界中の仕事で欠場しています。 背部の痛みは、医者の診察の2番目に一般的な理由であり、上気道感染症の数だけ多い。 人口のおよそ80%は、一生を通して少なくとも1回は腰痛を経験するでしょう。 脊椎は、他の軟部組織の中で骨、関節、靭帯、および筋肉からなる複雑な構造である。 このため、怪我および/または悪化した状態、例えば 椎間板ヘルニア最終的には、背痛の症状につながる可能性があります。 スポーツ傷害または自動車事故による傷害は、多くの場合、背痛の最も頻繁な原因であるが、時には最も単純な運動は痛い結果をもたらすことがある。 幸運なことに、カイロプラクティックケアのような代替治療の選択肢は、脊柱調節と手作業による腰痛の緩和に役立ち、究極的には疼痛緩和を改善する。

エキストラエキストラ| 重要なトピック:テキサス州エルパソの推奨カイロプラクティック
***
免責事項を投稿
ここに記載されている情報は「ミトコンドリア機能におけるNrf2の新たな役割「」は、資格のある医療専門家または資格のある医師との XNUMX 対 XNUMX の関係に代わるものではなく、医学的アドバイスでもありません。資格のある医療専門家との調査とパートナーシップに基づいて医療に関する決定を下すことをお勧めします。
私たちの情報範囲 カイロプラクティック、筋骨格、 鍼、 理学療法、健康、病因の一因となる 内臓障害 臨床プレゼンテーション、関連する体性内臓反射臨床ダイナミクス、亜脱臼複合体、敏感な健康問題、および/または機能医学の記事、トピック、およびディスカッション内。
私たちは提供し、提示します 臨床コラボレーション さまざまな分野の専門家とともに。 各専門家は、専門的な業務範囲とライセンスの管轄区域によって管理されます。 私たちは、機能的な健康とウェルネスのプロトコルを使用して、筋骨格系の損傷や障害の治療とケアをサポートします。
当社のビデオ、投稿、トピック、主題、および洞察は、当社の臨床業務範囲に関連し、直接的または間接的にサポートする臨床事項、問題、およびトピックをカバーしています。
私たちの事務所は、根拠となる引用を提供するよう合理的に努め、私たちの投稿を裏付ける関連する研究研究を特定しました。 リクエストに応じて、規制委員会や一般の人々が利用できる裏付けとなる調査研究のコピーを提供します。
特定のケアプランまたは治療プロトコルでどのように役立つかについての追加の説明が必要な事項をカバーしていることを理解しています。 したがって、上記の主題についてさらに議論するには、お気軽にお問い合わせください アレックス・ヒメネス博士、DC, をご覧いただくか、 915-850-0900.
私たちはあなたとあなたの家族を助けるためにここにいます。
祝福
アレックス・ヒメネス博士 DC、 MSACP, RN*、 CCST, IFMCP*, CIFM*, ATN*
Eメール: Coach@elpasofunctionalmedicine.com
カイロプラクティックドクター(DC)のライセンスを取得 テキサス州 & ニューメキシコ州*
テキサス DC ライセンス番号 TX5807、ニューメキシコ州 DC ライセンス番号 # NM-DC2182
正看護師(RN*)の免許を取得 フロリダ州
フロリダ州ライセンス RN ライセンス番号 RN9617241 (管理番号 3558029)
コンパクトステータス: 複数の州のライセンス: での練習を許可されています 40州*
現在入学済み: ICHS: MSN* FNP (家庭看護師プログラム)
アレックス・ヒメネス博士 DC、MSACP、RN* CIFM*、IFMCP*、ATN*、CCST
私のデジタル名刺


 再び私たちはあなたを歓迎します¸
再び私たちはあなたを歓迎します¸
